
Le groupe pharmaceutique américain Eli Lilly a déclaré mercredi que son nouveau traitement développé contre Alzheimer avait démontré, lors d'un essai clinique de grande ampleur, ralentir la progression de la maladie, une annonce qui ouvre la voie à sa possible autorisation prochaine.
Ces résultats ont été accueillis avec enthousiasme par les experts, qui n'ont pas hésité à saluer l'entrée dans une "nouvelle ère" pour la prise en charge de la maladie d'Alzheimer, grâce à plusieurs percées récentes.
L'essai clinique, qui comptait 1.200 participants ayant entre 60 et 85 ans et n'ayant pas encore atteint un stade avancé de la maladie, a montré une réduction de 36% du déclin cognitif des patients traités avec le donanemab, selon un communiqué de l'entreprise.
La capacité à accomplir des tâches du quotidien, comme conduire, converser, avoir des loisirs ou gérer ses finances, a également été mesurée. Sur 18 mois, les participants ayant reçu le traitement présentaient une réduction de 40% du déclin dans leur capacité à réaliser ces tâches.
Eli Lilly a dit prévoir de déposer une demande d'autorisation auprès de l'Agence américaine des médicaments (FDA) dès ce trimestre, et dans le monde "aussi vite que possible".
Le traitement peut toutefois entraîner des effets secondaires graves, comme des oedèmes ou hémorragies cérébrales. Trois participants à l'essai clinique sont décédés, selon le communiqué.
"Quand les résultats complets seront publiés" dans une revue scientifique, "nous pourrons commencer à évaluer attentivement les risques et les bénéfices, et cela aidera à décider si le donanemab doit être donné couramment aux patients", a commenté le Dr. Charles Marshall, de la Queen Mary University of London.
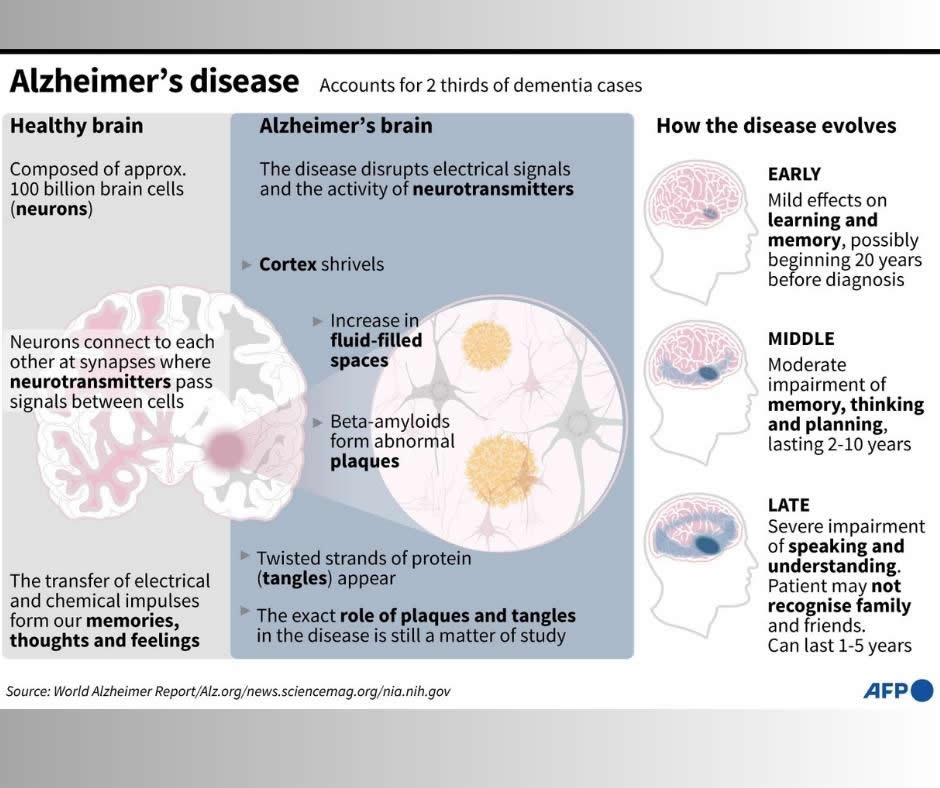
La maladie d'Alzheimer est une maladie neurodégénérative qui touche des dizaines de millions de personnes dans le monde, et pour laquelle il n'existe aucun traitement permettant une complète guérison. D'abord caractérisée par des pertes de mémoire, les patients perdent peu à peu la capacité de vivre normalement.
Nouvelle génération de traitements
"Ces résultats confirment que nous entrons dans l'ère du traitement d'Alzheimer", s'est réjouie Catherine Mummery, du National Hospital for Neurology and Neurosurgery à Londres. Il sera désormais possible "d'espérer de manière réaliste pouvoir traiter et stabiliser une personne atteinte de la maladie d'Alzheimer, avec une gestion de long terme, plutôt que des soins palliatifs et de soutien", a-t-elle ajouté.
"Je pense que ce traitement a le potentiel d'améliorer significativement la vie des patients et de leurs familles", a abondé de Dr. Marc Busche, de University College London (UCL).
La recherche dans la lutte contre la maladie d'Alzheimer a stagné durant des décennies.
Mais deux nouveaux traitements, développés par les entreprises pharmaceutiques japonaise Eisai et l'américaine Biogen, ont récemment été approuvés aux Etats-Unis: le Leqembi en janvier 2023 (dont le principe actif est nommé lecanemab), et avant cela l'Aduhelm (molécule aducanumab), en juin 2021.
Si l'autorisation de l'Aduhelm a été controversée, de nombreux experts critiquant le manque de preuves sur son efficacité, le lecanemab avait été le premier à démontrer clairement une réduction du déclin cognitif (de 27%) dans le cadre d'un essai clinique.
Le donanemab d'Eli Lilly, s'il est "approuvé aux côtés du lecanemab", pourrait "offrir un choix de traitements aux patients", s'est félicitée Liz Coulthard, professeure à l'Université de Bristol.
Tous ces nouveaux traitements ciblent les dépôts d'une protéine appelée bêta-amyloïde. Si la cause exacte de la maladie d'Alzheimer reste mal comprise, les cerveaux des patients présentent des plaques amyloïdes, qui se forment autour de leurs neurones et les détruisent à terme.
Accès limité
L'accès à ces traitements, administrés par intraveineuse et très chers, suscite le débat aux Etats-Unis.
Le système de couverture santé fédéral Medicare, destiné aux personnes de plus de 65 ans, avait annoncé ne les rembourser que s'ils étaient pris dans le cadre d'essais cliniques -- limitant de facto grandement leur accès.
Cette condition a été posée parce que la FDA a autorisé l'Aduhelm et le Leqembi selon une procédure accélérée, qui requiert de collecter moins de données cliniques afin de permettre la mise sur le marché plus rapide d'un traitement contre une pathologie grave.
"Medicare continue à s'entêter à bloquer l'accès pour les personnes qui pourraient en bénéficier", a critiqué mercredi dans un communiqué Maria Carrillo, responsable scientifique au sein de l'Alzheimer Association, qui réclame que ces restrictions d'accès soient levées.
li Lilly a indiqué mercredi vouloir déposer une demande pour une autorisation "traditionnelle" (et non accélérée), qui pourrait permettre une couverture plus large par Medicare.
Agence France-Presse

Notre service WhatsApp. Vous êtes témoins d`un événement d`actualité ou d`une scène insolite? Envoyez-nous vos photos ou vidéos sur le 5 259 82 00 !





















